
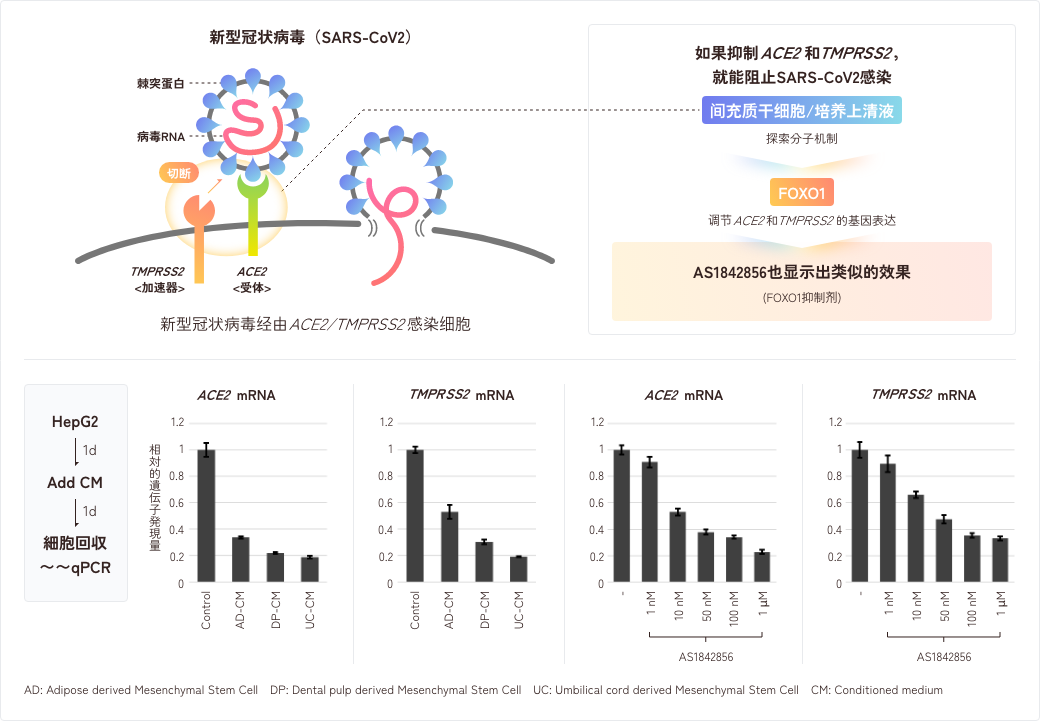
在非常早期的阶段,间充质干细胞(MSC)对肆虐全球的新型冠状病毒感染症(COVID-19)的有效性已显露端倪。关于其作用机制,许多研究小组提出了假设,即间充质干细胞的抗炎作用通过抑制细胞因子风暴有效地对抗COVID-19。
本公司在熟知MSC其拥有足够的抗炎作用的基础上,考虑其是否进而存在其他机制,并进行了研究。结果发现,间充质干细胞和其分泌的因子具有抑制ACE2和TMPRSS2两种感染介质的基因表达量的作用,ACE2是一种存在于细胞表面的蛋白质,充当新型冠状病毒的受体,TMPRSS2是一种细胞表面酶,可以提高新型冠状病毒感染的感染效率。
在进一步研究间充质干细胞及其分泌因子如何抑制ACE2和TMPRSS2表达的过程中,研究人员发现通过一种名为FOXO1的转录因子可以控制这两种基因的表达。当将FOXO1转录因子的抑制剂AS1842856添加到细胞中时,ACE2和TMPRSS2的表达呈浓度依赖性地被抑制,在模拟病毒感染实验中进一步也得到了提示感染被抑制的结果。目前,我们正在与其他研究机构进行合作研究,更进一步反复研讨。
因此,我们的目标是通过深入研讨间充质干细胞及其分泌物如何对疾病发挥作用以及其机制,来发现新的候选药物(药物种子)。
再生医疗存在的问题之一是“治疗所需的费用非常昂贵”。我们认为通过详细调查“间充质干细胞是如何治病的”这一机制,并通过探索新的药物种子,可以发现廉价且有效的新药物。当然,有些疾病只能通过间充质干细胞具有的多种功能来治疗。我们希望在对这一类疾病使用间充质干细胞治疗的同时,能够不断地寻找到新药物。